ABM-1310 获得了FDA批准用于治疗BRAF V600突变GBM的孤儿药资格认证
2023年08 月02日 璧辰医药 (ABM Therapeutics)宣布,公司自主研发的小分子BRAF抑制剂ABM-1310已经获得美国食品药品监督管理局(FDA)的孤儿药资格认证, 用于治疗BRAF V600突变的脑胶质母细胞瘤 (GBM)。
这个消息受到了业界的广泛的关注, 那么什么是罕见病?什么孤儿药?孤儿药资格认证对药物研发有何影响?ABM-1310又是如何获得了这一资格?
ABM-1310
ABM-1310是一种口服药物,具有高选择性、高水溶性和高血脑屏障通透性。它是璧辰医药自主研发的创新药物,用于治疗BRAF V600突变实体肿瘤。ABM-1310已经在美国和中国多家临床中心开展了针对BRAF V600突变晚期实体肿瘤的临床一期试验。临床研究显示ABM-1310在包括原发性脑肿瘤(包括GBM和其他脑胶质瘤等)在内的晚期实体肿瘤患者中具有良好的抗癌疗效,且安全性、耐受性良好。
ABM-1310 在获得FDA批准用于治疗BRAF V600突变GBM的孤儿药资格认证后,璧辰医药在ABM-1310研发中将获得一系列经济激励措施,从而有力支持ABM-1310在治疗BRAF V600突变GBM的研发,有望使BRAF V600突变GBM患者尽早获益。
罕见病和孤儿药的历史和发展
孤儿药一词随着 1983 年美国《孤儿药法案》的首次颁布而得到广泛使用。孤儿药又称为罕见药,用于预防、治疗、诊断罕见病的药品,由于罕见病患病人群少、市场需求少、研发成本高,很少有制药企业关注其治疗药物的研发,因此这些药被形象地称为孤儿药。
在美国2002年的《罕见病法案》将罕见病定义为在美国影响不到 20 万人的任何疾病或病症。超过 7,000 种罕见病影响着美国超过 3000 万人,许多罕见病会危及生命,而且大多数都无有效治疗手段。由于多种原因,包括缺乏对罕见病的复杂的生物学特征和对其自然病程的了解,罕见病的药物、生物制剂和设备的开发极具挑战性。患有罕见病的人数很少,这也增加了开展罕见病的临床试验进行新药研发的难度。《孤儿药法案》旨在激励开发治疗罕见病的药物,鼓励制药企业关注在患者极少(有时只有几千人)的疾病和病症的新药研发。自 1983 年该法案实施以来,FDA 已批准了数百种治疗罕见病的药物,但大多数罕见病仍然没有获得FDA 批准的治疗方法。 FDA 旨在与多方(例如患者、医务人员以及制药企业合作,持续支持治疗罕见病产品的开发。
1983 年《孤儿药法案》颁布以后,1983年至2019年间, 有5,099 个孤儿药资格认证,包含了 3,269 种产品,其中 508 种产品获得了 FDA批准罕见病适应症。仅具有单一罕见病适应症认证的产品占产品总数的 2,448 种(75%),其中 26 种(1%)产品拥有 10 个或更多的罕见病适应症的认证。在这些具有 10 个或更多的罕见病适应症认证的产品中,超过 60% 是抗肿瘤药物或免疫调节剂 (2)。孤儿药资格认证排名前三位的治疗领域是:肿瘤学(1910 个,37%)、神经病学(674 个,13%)和传染病学(436 个,9%)。从广泛的疾病分类发现,近十年来,儿科首发疾病的资格认证比例已增加至 27%。(3)
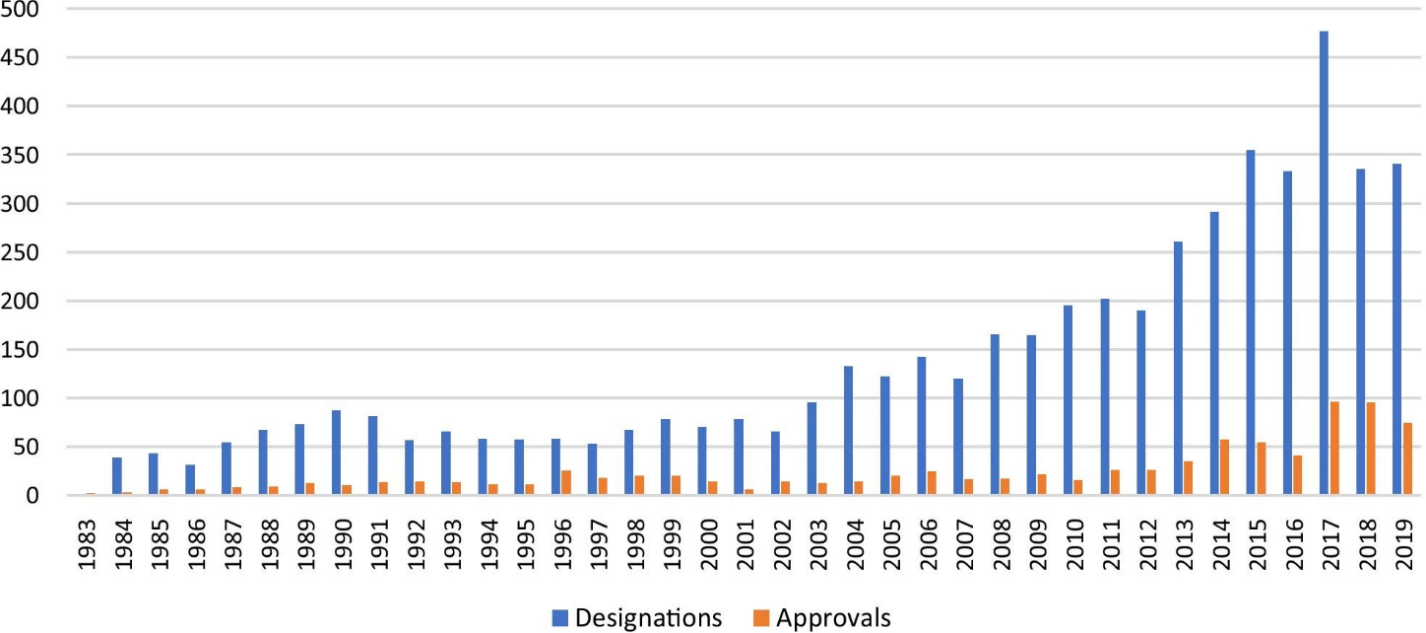
1983年至2012年间,孤儿药资格认证的数量呈现周期性趋势,出现多个波峰和波谷,且自2002年以来周期幅度普遍增加(上图)。然而,自 2013 年以来,我们看到孤儿药资格认证数量呈强劲上升趋势。(2)
孤儿药资格认证和优惠政策
制药企业可以向FDA申请孤儿药资格认证,如果药物符合特定标准,FDA 将授予此类资格。经FDA认定孤儿药资格的申办药企有资格获得各种优惠政策,包括:
1.合格临床(人体)试验的税收抵免
2.免除处方药使用者费用(目前新药近 300 万美元)
3.批准后可能享有 7 年市场独占权
此外,《孤儿药法案》设立了孤儿药产品补助计划,为开发罕见病或病症的产品提供资金。
申请药物孤儿药资格认证的申办者必须向监管机构提交资格认证申请。申请与先前已认定资格的产品治疗相同罕见病或病症的药物的资格认证,其申办者必须提交自己的数据和信息。孤儿药资格的申请与认证是一个独立于寻求批准或许可的过程。治疗罕见病的药物与任何其他药物一样要经过同样严格的科学审查程序才能获得上市销售的批准。
孤儿药的市场和花费

关于罕见病,目前已知的超过7000余种,约占人类疾病的10%,80%的罕见病是由于基因缺陷所导致的,然而目前只有不到5%的罕见病有治疗方法。针对罕见病的定义,美国的定义是患病人数低于20万的疾病或病症,美国的罕见病人数超过3000万,其中一半以上是儿童,且许多罕见病危及生命。
罕见病药物的研发与生产销售,一方面面临着研发难度大、研发成本高,另一方面罕见病的患者群体数量小意味着销售额小,这一经济现实意味着制药企业无法指望收回开发新药的投入,使得孤儿药的研发与生产曾经很长一段时间都处于困境中。因此,1973 年至 1983 年间,仅靠制药行业投资的支持,只有不到 10 种孤儿药产品获得FDA批准进入市场。
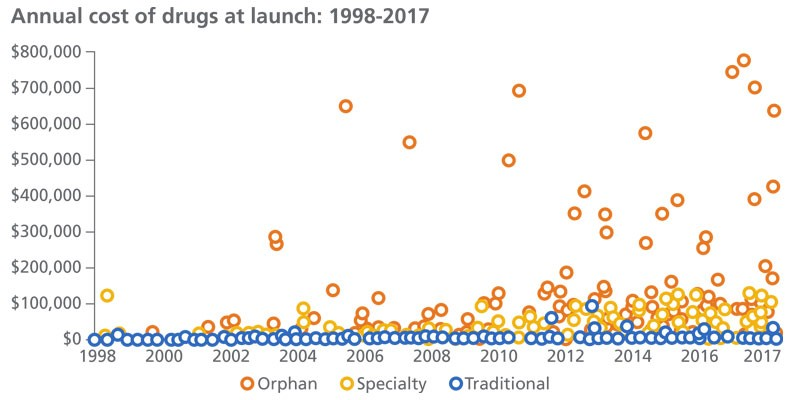
1983 年《孤儿药法案》的颁布以后,1983年至2019年间, 有5,099 个孤儿药资格获得认证,代表 了3,269 种产品,其中 508 种孤儿药获得了 FDA批准罕见病适应症。这些新药对使用者来说代表着巨大的进步。
虽然这对于那些现在正在接受治疗的人们来说是个好消息,但它的花费也是巨大的。这些疗法每年的费用高达 750,000 美元,而现在每位患者非孤儿药的平均年费用约为 147,000 美元,孤儿药是非孤儿药平均费用的四倍多。事实上,孤儿药目前占全球 处方药销售额的 17% (5)。
上图说明了随着潜在患者数量的减少,巨大的定价杠杆发挥了作用。所有售价 100,000 美元或以上的孤儿药均适用于少于 50,000 名患者。孤儿药的销售额预计将继续以快于其他药物的速度增长。到 2024 年,销售额预计每年增长 11%,而同期整个药品市场的增长率为 6.4%。目前正在开发的新药有望维持这一势头。到 2024 年,孤儿药的销售额可能占目前研发管线中所有药物销售额的三分之一以上。(6)
胶质母细胞瘤 (GBM)
GBM胶质母细胞瘤为WHO IV级脑胶质瘤,恶性程度最高,具有高侵袭性,治疗困难,在原发恶性脑肿瘤占比约50%,其BRAF V600突变率约8%。由于GBM的复杂性和抗药性,这种疾病的治疗面临着重重挑战。传统的治疗方法如手术切除、放疗和化疗仍无法完全控制疾病的进展,且药物选择也非常有限,需要更多创新和针对性的治疗方法。
璧辰医药
璧辰医药ABM Therapeutics (ABM)是一家临床阶段的新药研发公司。公司聚焦于可突破血脑屏障的小分子药物研发。其在研的小分子靶向抑制剂可突破血脑屏障,使药物入脑效率显著提高,有望解决肿瘤脑转移问题。ABM自成立以来稳健发展,已经在美国和中国设立了研发运营中心。公司通过自主研发,构建了丰富的入脑药物研发管线,已经成为富有特色的抗癌药物和入脑小分子药物的透脑激酶药物研发平台(BPKddTM)。(7)
参考文献:
1.https://www.fda.gov/patients/rare-diseases-fda
2. Drugs and biologics receiving FDA orphan drug designation: an analysis of the most frequently designated products and their repositioning strategies Expert Opin Orphan Drugs. 2022 Mar 1; 9(11-12): 265–272.
3. Using four decades of FDA orphan drug designations to describe trends in rare disease drug development: substantial growth seen in development of drugs for rare oncologic, neurologic, and pediatric-onset diseases。Orphanet Journal of Rare Diseases volume 16, Article number: 265 (2021)
4. https://phrma.org/en/Scientific-Innovation/Progress-in-Fighting-Rare-Diseases
5. EvaluatePharma® Orphan Drug Report May, 2018. Accessed January 28, 2019.
6. https://www.optum.com/business/insights/pharmacy-care-services/page.hub.orphan-drugs.html
7. www.abmtx.com

